Il microbioma intestinale può aiutare nel determinare la risposta all’immunoterapia impiegata nel trattamento dei tumori? Secondo due lavori pubblicati nei giorni scorsi su Science sembrerebbe proprio di sì.
Due gruppi di ricerca indipendenti, rispettivamente guidati da Laurence Zitvogel, del Gustave Roussy Cancer in Francia, e da Jennifer Wargo, dell’Anderson Cancer Center di Houston, hanno analizzato il grado di risposta alla immunoterapia con inibitori del checkpoint immunitario (ICI), relazionandolo alla diversa composizione del microbioma intestinale di pazienti con svariati tipi di tumori, alcuni di essi sottoposti nel periodo antecedente lo studio con trattamento antibiotico.
In particolare hanno valutato la risposta agli inibitori di PD-1 (programmed cell death protein) e dei loro ligandi PD-L1. Nonostante questi anticorpi monoclonali siano di fatto gli ICI più utilizzati nella terapia corrente, i benefici clinici si riscontrano solamente in un quarto circa dei pazienti trattati.
A sostenere l’ipotesi di ricerca dei due team troviamo alcuni studi pubblicati sempre su Science gli scorsi anni. Tali lavori hanno dimostrato come in modelli murini un cambio di microbiota intestinale possa influenzare la risposta a questi farmaci.
I due team hanno quindi voluto verificare questo dato anche nell’uomo.
Immunoterapia, responder e non responder
Gli studi presentati sono complessi e i dati raccolti sono davvero molti. Ecco i risultati principali.
Il team condotto da Zitvogel ha esaminato 249 pazienti con diversi tipi di tumore (melanoma, polmone, rene, vescica) trattati con inibitori di PD-1/PDL-1, 69 dei quali hanno assunto antibiotici per ragioni non correlate al cancro stesso in un arco di tempo prossimo allo studio.
Per l’analisi del microbioma sono stati quindi suddivisi in responder (R) e non responder (NR) alla immunoterapia in base ai criteri di linea-guida RECIST, tenendo tuttavia presente il pre-trattamento o meno con antibiotici.
Oltre ai parametri clinici della responsività alla terapia, cioè la riduzione del tumore, correlati a una particolare composizione del microbioma, sono stati valutati anche aspetti come la sopravvivenza libera da progressione della malattia (PFS) e la sopravvivenza totale (OS).
I pazienti che avevano assunto antibiotici hanno dimostrato una generale riduzione di risposta terapeutica agli anti PD-1/PDL-1 e di conseguenza una minore PFS e OS. Questo conferma il fatto di come una disbiosi intestinale possa influenzare l’efficacia clinica degli ICI.
Dall’analisi e confronto dei microbiomi ottenuti con campioni fecali dei R vs NR si sono notate differenze soprattutto nel grado di espressione del genere Akkermansia muciniphila, maggiormente presente nei pazienti R e positivamente associabile anche ad un aumento di oltre 3 mesi di sopravvivenza libera da progressione della malattia.
In questo gruppo over-espressi si sono dimostrati anche Rominococcus spp., Alistipes spp. e Eubacterium spp., mentre minori rispetto ai NR sono risultati Bifidobacterium adolescentis, Bifidobacterium longum e Parabacteroides distasonis.
Per testare l’effettiva correlazione tra Akkermansia muciniphila e la risposta agli inibitori PD-1/PDL-1, è stata effettuata una trasposizione per via orale di microbiota fecale rispettivamente di pazienti R e NR su modelli murini germ-free e privi di un loro microbiota intestinale.
Questa ulteriore prova in vivo ha confermato i dati clinici. Topi che avevano ricevuto microbiota fecale da soggetti rispondenti, quindi con marcata presenza di Akkermansia muciniphila, hanno dimostrato una risposta terapeutica superiore ai farmaci immuno-oncologici rispetto all’altro gruppo. Ma non solo: è stata rilevata una riduzione significativa della dimensione tumorale e un maggiore accumulo di cellule immunitarie a livello del microambiente canceroso.
Sembrerebbe infatti aumentato il rilascio di citochine IL12, le quali supportano il ruolo dei linfociti T, in risposta alla presenza significativa di Akkermansia muciniphila. Il meccanismo d’azione con cui queste specie batteriche riescano a influenzare la risposta a farmaci immuno-oncologici rimane tuttavia ancora poco chiara.
PD1 e melanoma, lo studio di Jennifer Wargo
Il gruppo coordinato da Wargo si è invece focalizzato sul melanoma cutaneo attraverso la raccolta e il confronto di campioni di microbiota orale e fecale di 89 pazienti in terapia da almeno sei mesi con anti-PD1, suddivisi anche in questo studio tra R e NR.
La differenza quali-quantitativa a livello del microbiota tra i due gruppi è stata riconfermata per quanto riguarda quello fecale, nessuna differenza rilevante si è invece riscontrata in quello dei campioni orali.
I soggetti R hanno dimostrato una maggiore biodiversità con marcata presenza di Clostridiales e Ruminococcaceae bacteria, Faecalibacterium in particolar modo, mentre nei NR più espressi sono risultati i Bacteroidales tra i quali soprattutto Bacteroides thetaiotaomicron, Escherichia coli e Anaerotruncus colihominis. Anche in questo secondo studio è stata approfondita e confermata la correlazione tra genere batterico caratterizzante il microbiota dei rispondenti alla immunoterapia e la PFS.
Un’alta concentrazione di Faecalibacterium è risultata positivamente correlata a una maggiore sopravvivenza libera da progressione. Al contrario, una marcata presenza di Bacteroidales sembrerebbe farla diminuire. Risultati in linea con quelli di Zitvogel e del suo gruppo si sono ottenuti anche nel test di trasposizione di microbioma fecale di pazienti R e NR in modelli murini.
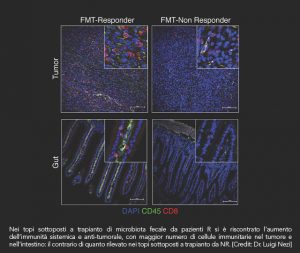
Stando a quanto emerso da questi due recentissimi studi si può affermare come il microbioma intestinale possa influenzare la risposta a farmaci immuno-oncologici quali anti-PD1/PDL1 in diversi tipi di cancro e di come a una sua correzione in soggetti non rispondenti tramite trapianto di microbiota potrebbe comportare benefici clinicirilevanti. Nonostante questo secondo punto sia stato verificato solamente nei modelli in vivo, le prospettive per una sua applicazione nell’uomo si dimostrano favorevoli oltre che il proseguimento delle ricerche su questa linea.