Recentemente la rivista Gastroenterology ha pubblicato una interessante review, intitolata “Pathobionts in Inflammatory Bowel Disease: Origins, Underlying Mechanisms, and Implications for Clinical Care”, a firma di Ashley Gilliland e collaboratori (GE 2024;166:44–58).
Eccone un breve riassunto: il microbiota intestinale svolge un ruolo significativo nella patogenesi di entrambe le forme di malattia infiammatoria intestinale (IBD), ossia la malattia di Crohn (CD) e la colite ulcerosa (UC). Sebbene le evidenze indichino che disbiosi e perdita di specie microbiche benefiche possano esacerbare l’IBD, molti nuovi studi hanno identificato nei pazienti affetti da IBD la presenza intestinale di microrganismi con qualità patogene, definiti “patobionti”.
Il concetto di patobionti come iniziatori o fattori di cronicizzazione della IBD si è a lungo concentrato sul possibile ruolo aggravante esercitato da Escherichia coli aderente-invasiva nella CD. Tuttavia, studi recenti hanno identificato ulteriori patobionti batterici e fungini in pazienti con CD e UC. La review mette in evidenza le caratteristiche di questi patobionti e le implicazioni terapeutiche nell’IBD. Oltre a esplorarne le origini, vengono discussi i patobionti associati a specifiche manifestazioni cliniche e i possibili meccanismi coinvolti, come il “creeping fat” (Clostridium innocuum) e il deficit di guarigione delle ferite (Debaryomyces hansenii) nei pazienti con CD, così come l’aumentata attività proteolitica fecale (Bacteroides vulgatus) quale biomarcatore di severità della UC. Infine, vengono esaminati i potenziali effetti dei patobionti sulle attuali terapie per IBD e alcuni nuovi approcci mirati ai patobionti, ancora nelle fasi iniziali di sviluppo.
La figura seguente, tratta dall’articolo, illustra alcune delle nuove terapie proposte per l’IBD, specificamente indirizzate ai patobionti.
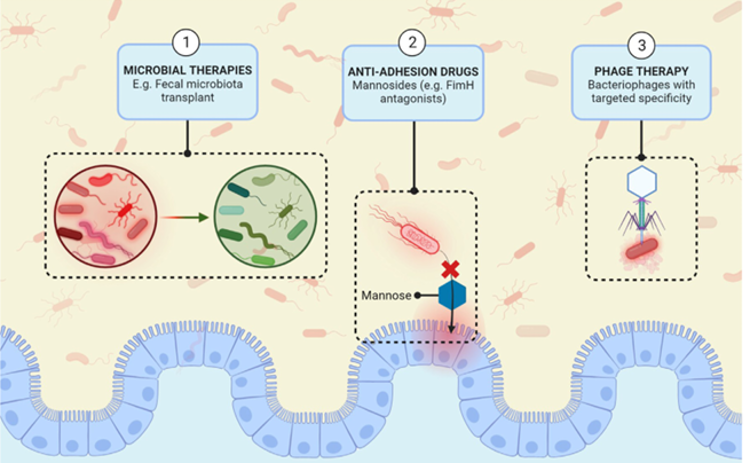
L’articolo è interessante perché getta luce sul tipo specifico di disbiosi presente nella IBD, caratterizzata non solo da una ridotta diversità microbica e da bassi livelli di batteri anti-infiammatori, ma anche da un aumento di microrganismi potenzialmente dannosi, i cosiddetti patobionti.
Collegato al tema dei patobionti nella IBD, ho trovato particolarmente rilevante un commento pubblicato sul numero di marzo (Gastroenterology 2025;168:439–443) da N. Andreani e D. Unterweger [dell’Università di Kiel, Germania, e del Max Planck Institute, rispettivamente], che introduce il concetto di Medicina Evoluzionistica nell’origine della disbiosi specifica che porta alla IBD.
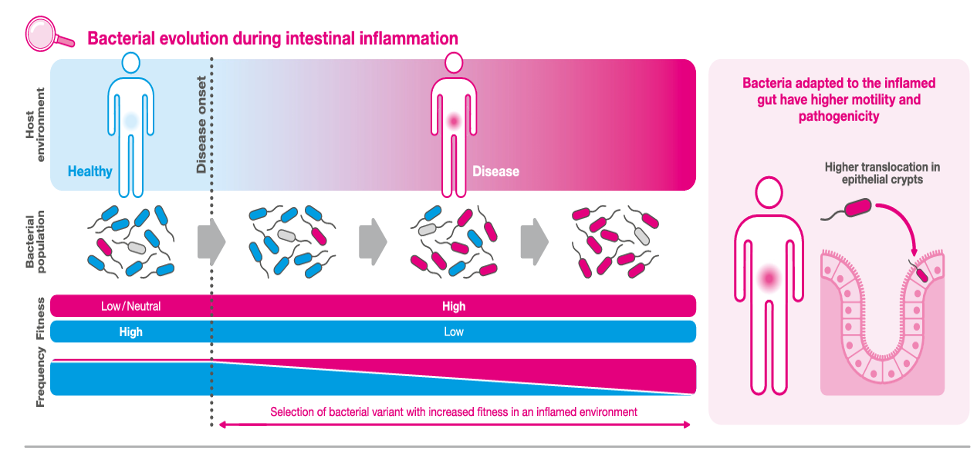
Gli autori hanno analizzato quattro recenti studi sperimentali che mostrano l’adattamento evolutivo dei batteri intestinali all’infiammazione in poche settimane; tali cambiamenti aumentano la virulenza batterica negli individui con intestino infiammato. Gli autori affermano che “un’analisi del microbioma intestinale dei pazienti con IBD ha identificato linee batteriche adattate all’infiammazione che si sono evolute in milioni di anni”. Concludono sostenendo che “queste scoperte gettano le basi per la medicina evoluzionistica nei pazienti con intestino cronicamente infiammato.
Siamo all’alba di una nuova era nella terapia gastroenterologica con il potenziale di nuove opzioni terapeutiche basate sull’evoluzione”.
Il concetto interessante, a mio avviso, è che specifici patobionti siano in grado di evolversi in presenza di infiammazione intestinale, come riassunto nella figura seguente e che tale processo sia potenzialmente reversibile in una fase precoce.
Ancora una volta, una terapia diretta contro questi patogeni può includere una terapia microbica (probiotici), secondo lo schema riportato.
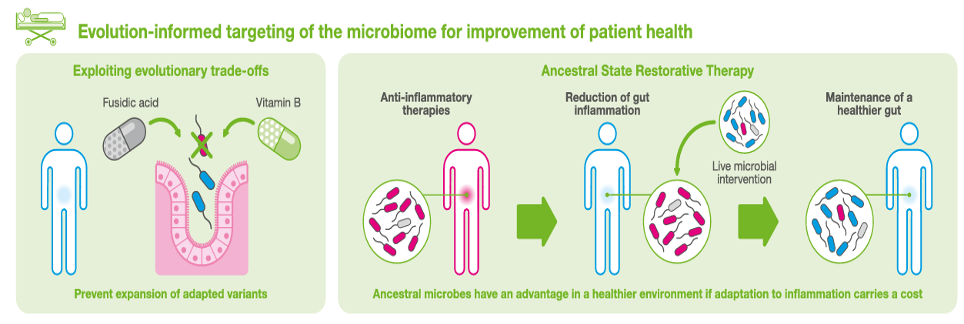
Il problema resta come identificare precocemente una coorte di potenziali pazienti.
Una possibile risposta arriva da un altro studio pubblicato questo mese su Gastroenterology (GE 2025;168:99–110) da Pablo A. Olivera e colleghi, che mostra come i parenti di primo grado (FDRs) non affetti provenienti da famiglie con ≥2 FDR affetti da malattia di Crohn (CD, famiglie multiplex) abbiano un rischio triplo di sviluppare la CD, rischio che può essere quantificato tramite uno score sviluppato dagli autori.
Interessante notare che, tra i 4051 partecipanti di famiglie simplex e i 334 di famiglie multiplex con CD, lo status di multiplex CD era significativamente associato a valori basali più elevati di calprotectina fecale (P = .026), ma non a un’aumentata permeabilità intestinale, valutata con il rapporto lattulosio/mannitolo. Tre generi batterici (uno appartenente al genere Prevotella) risultavano differenzialmente abbondanti tra i due gruppi.
A mio avviso, gli studi citati sono rilevanti per le future ricerche nello sviluppo e nella terapia probiotica. Tali probiotici dovrebbero essere diretti contro specifici patobionti e possibilmente somministrati ai parenti non affetti dei pazienti con IBD.
Si potrebbe considerare questo un ambito di nicchia, sebbene molto rilevante. Ma, nonostante la relativamente bassa prevalenza della IBD (negli USA, l’incidenza è stimata in 721 casi ogni 100.000 persone; questo significa che più dello 0,7% degli americani soffre di IBD, ovvero quasi 1 su 100), il numero dei parenti può essere moltiplicato per 2, 3 o più, rendendo la nicchia altamente significativa.
🖋️ Fabio Pace
Direttore del Microbiota Center, ICH, Rozzano (Italia)












